BDCA2/CLEC4C:一种新型浆细胞样树突状细胞pDC标记物,干扰素α/β强效抑制剂,阻断SLE红斑狼疮!
日期:2023-08-09 11:27:27
近期,Rheumatology杂志发表了一篇题为“An immunomodulatory antibody-drug conjugate (ADC) targeting BDCA2 strongly suppresses pDC function and glucocorticoid responsive genes”的研究论文 [1]。该研究发现一种新型的BDCA2抗体偶联物(BDCA2-ADC),能够有效地抑制系统性红斑狼疮(Systemic Lupus Erythematosus,SLE)。在SLE中,浆细胞样树突状细胞(pDC)过度产生I型干扰素(IFN-I),而BDCA2/CLEC4C被认为是这种自身免疫反应的关键。
BDCA2/CLEC4C是一种在浆细胞样树突状细胞pDC上表达的新型标记物。研究者将抗BDCA2抗体与糖皮质激素受体激动剂结合,形成BDCA2-ADC。实验表明BDCA2-ADC能抑制pDC中的IFN-I信号和糖皮质激素反应。这些数据表明,BDCA2具有双重机制作用于pDC。陆续研究证实,BDCA2/CLEC4C有望成为全球首个用于SLE治疗的ADC,为SLE患者提供更好的治疗选择!
1. 什么是浆细胞样树突状细胞(pDC)?
浆细胞样树突状细胞(pDC)是树突状细胞(DC)的一种亚类,专门用于分泌I型干扰素(IFN-I)。pDC通过大量分泌IFN-I来激活适应性免疫反应,并在机体抗病毒免疫中起关键作用。在免疫应答中,pDC通过TLR7和TLR9来识别病原体相关分子,并产生丰富的干扰素α(IFN-α)。IFN-α是一种强有力的抗病毒干扰素,可以抑制病毒的复制和传播,并激活其他免疫细胞参与免疫反应。pDC被认为是已知分泌IFN-α能力最强的细胞之一 [2-4]。
未成熟的pDC在人体的淋巴结、扁桃腺、外周血、脐带血以及成人和胎儿的胸腺、胎肝和胎骨髓中都有发现。pDC异常的活化和过度产生的IFN-α与自身免疫性疾病(如系统性红斑狼疮)、病毒感染(如乙型肝炎病毒HCV、HIV),以及某些白血病和淋巴瘤等肿瘤有关 [2, 5-8]。然而,这些疾病的发病机制非常复杂。根据现有研究,已鉴定了四种新的人类pDC表面标记物,它们分别是BDCA2、BDCA4、ILT-7和CD123 [2, 5-8]。
2. 什么是CLEC4C?
CLEC4C(也称为BDCA-2或CD303)是C型凝集素家族的第4个成员(C-type lectin domain family 4 member C)。CLEC4C是一类含有213个氨基酸的新的二型跨膜糖蛋白,属于钙依赖性凝集素家族。CLEC4C主要表达在pDC的表面,该受体的自然配体尚未明确。CLEC4C/BDCA-2的细胞外部分包含C型碳水化合物识别结构域(C-type carbohydrate recognition domain,CRD),该结构域具有与甘露糖、葡萄糖或氨基葡萄糖结合的C型动物凝集素相似的特征序列。然而,据报道BDCA-2选择性地结合以半乳糖为末端的双天冠N-链接糖。X射线晶体学和突变研究结果显示,甘露糖与保守的Ca2+结合在主要结合位点上,该位点具备C型碳水化合物识别结构域的特征 [7-9]。
CLEC4C/BDCA-2作为血浆树突状细胞的标记物之一。它在免疫系统中发挥重要作用,特别是在自身免疫性疾病,如系统性红斑狼疮(SLE)。研究提示,BDCA-2可能通过一种依赖于钙动员和蛋白酪氨酸的机制,有效地抑制了浆细胞样树突状细胞中干扰素α/β产生的诱导。由于浆细胞样树突状细胞产生干扰素α/β被认为是系统性红斑狼疮的主要病理生理因素。因此,CLEC4C/BDCA-2成为阻断系统性红斑狼疮产生干扰素α/β的潜力靶点 [7-9]!
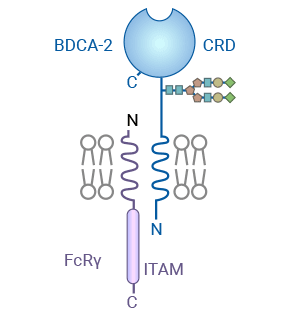
图1. CLEC4C/BDCA-2和其他含有C型CRD的2型跨膜受体的结构 [9]
3. CLEC4C在浆细胞样树突状细胞(pDC)免疫反应中的负向调控机制
CLEC4C/BDCA-2作为最新鉴定的pDC表面标记物之一,其胞外部分含有C型碳水化合物识别域,可以与甘露糖、葡萄糖或N-乙酰葡糖胺结合。虽然BDCA-2的胞内部分缺少已知的信号基序,但它与FcR γ链有关,并能通过FcR γ链在B细胞抗原受体样信号体中发出信号。激活BDCA-2会引发酪氨酸激酶(Syk)的活化、B细胞连接蛋白(SLP65)的聚集和磷脂酰肌醇特异性磷酯酶(PLCγ2)的活性。这个过程显示了BDCA-2在pDC中调节免疫应答和干扰素产生的机制(图2)[3, 10]。
PLCγ2的激活可能导致Ca2+流入并在浆细胞样树突状细胞pDC中起到负调节剂的作用。通过BDCA-2的信号传导途径减少NFKB(核因子κB)的活化,从而抑制I型干扰素(IFN-Ⅰ)的产生。因此,BDCA-2在pDC中可通过抑制干扰素产生,影响免疫应答,对免疫系统的调控具有重要影响(图2)[3, 10]。
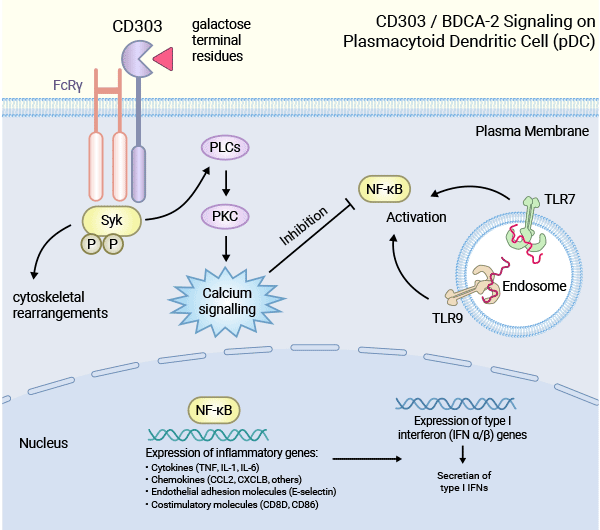
图2. CLEC4C/BDCA-2在浆细胞样树突状细胞(pDC)免疫反应中的负向调控机制 [10]
4.CLEC4C在系统性红斑狼疮SLE和HCV等疾病中的作用
4.1 CLEC4C在系统性红斑狼疮SLE中的作用
系统性红斑狼疮(SLE)是一类累及多脏器的自身免疫性疾病,其发病机制至今未明。如前所述,pDC是免疫系统中重要的抗病毒防御细胞,它们负责产生大量的干扰素-α(IFN-I)以应对感染。然而,在SLE患者中,pDC功能异常和IFN-I的产生过高,引发免疫反应并促进炎症反应,从而加剧SLE的病情。因此,IFN-I被认为是导致SLE发展的关键因素之一 [11]。
目前,许多研究已证实CLEC4C/BDCA-2作为新型浆细胞样树突状细胞主要表达分子,可介导抗原捕获,是干扰素α/β的强效抑制剂,从而调节自身免疫性疾病的发展,尤其是系统性红斑狼疮。例如,24F4A是一种针对BDCA-2的人源化单克隆抗体(mAb)。通过在健康和SLE患者的血液样本上进行体外实验,验证了24F4A与BDCA2结合并引发其内化,从而抑制pDC通过TLR诱导的IFN-I产生 [12-13]。
4.2 CLEC4C在丙型肝炎病毒HCV中的作用
研究发现,BDCA-2/CLEC4与丙型肝炎病毒(Hepatitis C Virus,HCV)颗粒或感染细胞表面的分子结构相互作用,能够识别病原体并启动免疫反应。除了HCV,BDCA-2还可以识别其他病毒,如HIV、流感病毒和登革热病毒等。一旦与病原体结合,BDCA-2能够激活pDC,促使其产生大量的IFN-I,从而抑制病毒的复制和传播 [14]。
研究表明,BDCA-2/CLEC4与HCV E2蛋白相互作用,并影响pDC对HCV感染的免疫反应。使用ELISA和RT-PCR检测了E2对pDC产生IFN-α和其他炎症因子的影响,并使用Western blot检测了E2对pDC内信号通路的影响。结果显示,E2能够结合BDCA2,并抑制pDC对HCV感染肝细胞或TLR7激动剂的反应,从而降低IFN-α和其他炎症因子的产生 [14]。
4.3 CLEC4C在其它疾病中的作用
目前,虽然国内外关于CLEC4C/BDCA-2的报道和研究有限,但相关研究表明BDCA-2在多种疾病中可能扮演重要角色,包括慢性炎症、感染性疾病和自身免疫疾病。这些疾病涉及子宫内膜异位症,鼻炎,哮喘,糖尿病和淋巴结炎等 [15-17]。此外,BDCA-2还与疱疹病毒EBV,HIV,以及某些真菌感染相关 [10-18]。在血液瘤和实体瘤治疗方面,BDCA-2也可能发挥作用 [19-22]。
例如,BDCA-2在肿瘤型浆细胞样树突状细胞中是具有高度特异性的标记物,进一步研究认为抗BDCA-2(CD303)抗体有望作为诊断原始样浆细胞树突状细胞肿瘤(BPDCN)辅助工具,以提高诊断的准确性 [21];CD4+CD56+血液皮肤肿瘤中的BDCA-2表达与肿瘤的特征和生存时间相关。通过对19例CD4+CD56+血液皮肤肿瘤的研究,发现其中10例肿瘤表达BDCA-2,而NK细胞系肿瘤中未观察到表达 [22]。
5. CLEC4C的临床在研药物
来自Pharmsnap的数据表明,目前全球针对CLEC4C/BDCA-2药物已有4款(Litifilimab;DB-2304;CBS-004;CDX-1402)。其中,渤健生物公司(Biogen, Inc.)开发的BDCA-2单抗BIIB 059(Litifilimab)是目前进展最迅速的一种药物。该药物通过抑制BDCA-2蛋白,减少炎性细胞因子如IFN-I的产生,从而能够有效治疗红斑狼疮。BIIB-059是全球唯一一款进入临床试验阶段的BDCA-2单抗。目前在美国,针对系统性红斑狼疮(SLE)的治疗已经进展至临床III期,而针对慢性皮肤红斑狼疮(CLE)的治疗则进展至临床II期。尽管目前的变化并不大,但这一领域的研究仍在不断进行,我们可以期待未来会有更多创新的CLEC4C/BDCA-2药物问世。
为鼎力协助科研和药企人员针对CLEC4C在系统性红斑狼疮等疾病中的临床应用研究,CUSABIO推出CLEC4C活性蛋白(Code: CSB-MP764932HU),助力您在CLEC4C机制方面的研究或其潜在临床价值的探索。
CLEC4C蛋白
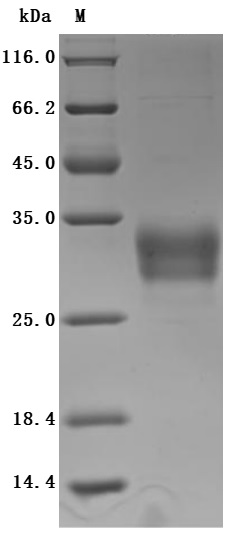
Purity was greater than 95% as determined by SDS-PAGE.(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
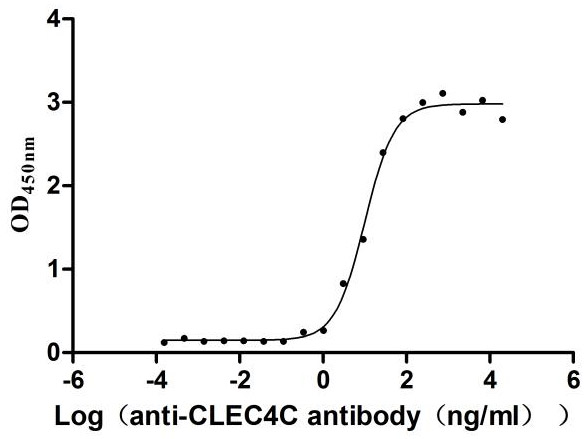
Immobilized Human CLEC4C at 2μg/mL can bind Anti-CLEC4C recombinant antibody (CSB-RA855470MA1HU),the EC50 is 7.658-12.99 ng/mL.
参考文献:
[1] Li, Xi, et al. "An immunomodulatory antibody-drug conjugate (ADC) targeting BDCA2 strongly suppresses pDC function and glucocorticoid responsive genes." Rheumatology (Oxford, England) (2023): kead219-kead219.
[2] Wu, Jing, et al. "pDC activation by TLR7/8 ligand CL097 compared to TLR7 ligand IMQ or TLR9 ligand CpG." Journal of Immunology Research 2019 (2019).
[3] Santana-de Anda, Karina, et al. "Plasmacytoid dendritic cells: key players in viral infections and autoimmune diseases." Seminars in arthritis and rheumatism. vol. 43. no. 1. wb Saunders, 2013.
[4] Rogers, N. M., J. S. Isenberg, and A. W. Thomson. "Plasmacytoid dendritic cells: no longer an enigma and now key to transplant tolerance?" American Journal of Transplantation 13.5 (2013): 1125-1133.
[5] Hardy, Andrew W., et al. "HIV turns plasmacytoid dendritic cells (pDC) into TRAIL-expressing killer pDC and down-regulates HIV coreceptors by Toll- like receptor 7-induced IFN-α." Proceedings of the National Academy of Sciences 104.44 (2007): 17453-17458.
[6] Fitzgerald-Bocarsly, Patricia, and Evan S. Jacobs. "Plasmacytoid dendritic cells in HIV infection: striking a delicate balance." Journal of leukocyte biology 87.4 (2010): 609-620.
[7] Reizis, Boris. "Regulation of plasmacytoid dendritic cell development." Current opinion in immunology 22.2 (2010): 206-211.
[8] Toma-Hirano, Makiko, et al. "Type I interferon regulates pDC maturation and Ly49Q expression." European journal of immunology 37.10 ( 2007): 2707-2714.
[9] Jégouzo, Sabine AF, et al. "A novel mechanism for binding of galactose-terminated glycans by the C-type carbohydrate recognition domain in blood dendritic cell antigen 2." Journal of Biological Chemistry 290.27 (2015): 16759-16771.
[10] Wilson, Nathaniel R., et al. "CD303 (BDCA-2)-a potential novel target for therapy in hematologic malignancies." Leukemia & lymphoma 63.1 (2022): 19-30.
[11] Furie, Richard A., et al. "Trial of anti-BDCA2 antibody litifilimab for systemic lupus erythematosus." New England Journal of Medicine 387.10 (2022). 894-904.
[12] Furie, Richard, et al. "Monoclonal antibody targeting BDCA2 ameliorates skin lesions in systemic lupus erythematosus." The Journal of clinical investigation 129.3 (2019): 1359-1371.
[13] Gardet, Agnes, et al. "Effect of in vivo hydroxychloroquine and ex vivo anti-BDCA2 mAb treatment on pDC IFNα production from patients affected with cutaneous lupus erythematosus." Frontiers in immunology 10 (2019): 275.
[14] Florentin, Jonathan, et al. "HCV glycoprotein E2 is a novel BDCA-2 ligand and acts as an inhibitor of IFN production by plasmacytoid dendritic cells." Blood, The Journal of the American Society of Hematology 120.23 (2012): 4544-4551.
[15] Lynch, Jason P., et al. "The plasmacytoid dendritic cell: at the cross-roads in asthma." European Respiratory Journal 43.1 (2014): 264-275.
[16] Van Brussel, Ilse, et al. "Expression of dendritic cell markers CD11c/BDCA-1 and CD123/BDCA-2 in coronary artery disease upon activation in whole blood ." Journal of immunological methods 362.1-2 (2010): 168-175.
[17] Migita, K., et al. "Reduced blood BDCA-2+ (lymphoid) and CD11c+ (myeloid) dendritic cells in systemic lupus erythematosus." Clinical & Experimental Immunology 142.1 (2005): 84-91.
[18] Ibrahim, Hazem Ahmed Hamed. "Pathogenesis of B-cell post-transplant lymphoproliferative disorders and HIV-associated B-cell lymphomas." (2010).
[19] Palma, Giuseppe, et al. "Plasmacytoids dendritic cells are a therapeutic target in anticancer immunity." Biochimica et Biophysica Acta (BBA)-Reviews on Cancer 1826.2 (2012): 407-414.
[20] Wertel, F., et al. "Myeloid and lymphoid dendritic cells in the peritoneal fluid of women with ovarian cancer." Adv Med Sci 51 (2006): 174-177.
[21] Boiocchi, Leonardo, et al. "BDCA-2 (CD303): a highly specific marker for normal and neoplastic plasmacytoid dendritic cells." Blood, The Journal of the American Society of Hematology 122.2 (2013): 296-297.
[22] Jaye, David L., et al. "Expression of the plasmacytoid dendritic cell marker BDCA-2 supports a spectrum of maturation among CD4+ CD56+ hematodermic neoplasms." Modern pathology 19.12 (2006): 1555-1562.











