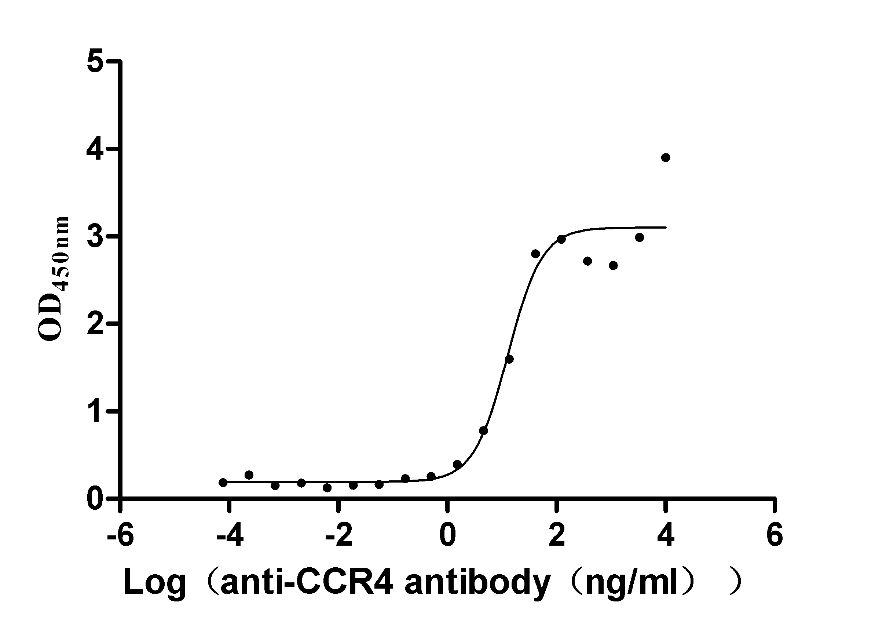
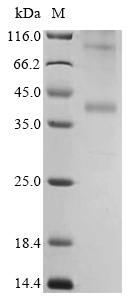
去垢剂技术平台
1. 背景和基本原理
跨膜蛋白在细胞功能调控和信号传导中发挥着重要作用,在生物学研究和药物开发中具有极高的价值 [1]。然而,传统的表达系统很难实现跨膜蛋白的有效表达和提取,这主要是由于跨膜蛋白具有复杂的空间结构和疏水性特征 [2]。去垢剂技术平台,通过在细胞膜上形成洗涤剂小分子团簇(detergent micelle),模拟细胞膜的环境,可实现跨膜蛋白的表达和提取 [3]。
2. 去垢剂技术与表达系统
去垢剂技术可以应用于多种表达系统,包括细菌、酵母、昆虫细胞、哺乳动物细胞和无细胞表达系统。每种表达系统都有其独特的优缺点,需要根据实际需求进行选择。
无细胞表达系统的优点在于可以在较短的时间内获得目标蛋白,无需细胞培养和分离步骤,同时可以更好地控制实验条件 [4]。应用去垢剂技术,无细胞表达系统可以通过添加合适的洗涤剂来实现跨膜蛋白的表达和稳定 [5]。然而,无细胞表达系统在蛋白质翻译、折叠和修饰方面可能存在一定的局限性 [6]。
3. 跨膜蛋白的提取和纯化
在使用去垢剂技术提取和纯化跨膜蛋白时,关键的一步是选择合适的洗涤剂。洗涤剂的类型、浓度和温度等条件对跨膜蛋白的提取效果具有显著影响 [7]。在实验过程中,需要尝试不同的洗涤剂,以优化蛋白提取的效果。此外,纯化方法的选择也对最终获得的跨膜蛋白质量产生重要影响,可以采用诸如亲和层析、离子交换层析和凝胶渗透层析等技术 [8]。
4. 华美生物去垢剂平台技术优势
华美生物在长期积累的跨膜蛋白表达和纯化经验基础上,通过多种去垢剂的选择和联合使用,可有效提高总蛋白中目的跨膜蛋白含量,且保证其构象正确、稳定。平台优势特色如下:

- 可全长表达多次跨膜蛋白,不仅仅只限于ECD表位
- 可精确定量,区别于VLP和Nanodisc平台
- 可应用于免疫/ELISA/SPR/BLI
目前,华美生物通过改良的跨膜蛋白纯化技术,已成功开发出12次跨膜的SLC7A11等蛋白、7次跨膜的EDNRB、ACKR1、CCR2等蛋白、6次跨膜的AQPZ、AQP1等蛋白、5次跨膜的ABCD1等蛋白、3次跨膜的SLC31A1等蛋白以及1次跨膜的SLFN12L蛋白等稀缺产品。
参考文献:
[1] Overington, J. P., Al-Lazikani, B., & Hopkins, A. L. (2006). How many drug targets are there? Nature Reviews Drug Discovery, 5(12), 993-996.
[2] Bill, R. M. (2015). Playing catch with membrane proteins. Science, 347(6226), 1072-1073.
[3] Zhang, M., & Chiu, C. (2019). Membrane protein structure determination using detergent micelle platforms. FEBS Journal, 286(2), 418-428.
[4] Smith, M. T., Hawes, A. K., & Bundy, B. C. (2013). Reengineering viruses and virus-like particles through chemical functionalization strategies. Current Opinion in Biotechnology, 24(4), 620-626.
[5] Shimizu, Y., Inoue, A., Tomari, Y., Suzuki, T., Yokogawa, T., Nishikawa, K., & Ueda, T. (2001). Cell-free translation reconstituted with purified components. Nature Biotechnology, 19(8), 751-755.
[6] Carlson, E. D., Gan, R., Hodgman, C. E., & Jewett, M. C. (2012). Cell-free protein synthesis: applications come of age. Biotechnology Advances, 30(5), 1185-1194.
[7] Seddon, A. M., Curnow, P., & Booth, P. J. (2004). Membrane proteins, lipids and detergents: not just a soap opera. Biochimica et Biophysica Acta (BBA) - Biomembranes, 1666(1-2), 105-117.
[8] Grisshammer, R., & Tate, C. G. (1995). Overexpression of integral membrane proteins for structural studies. Quarterly Reviews of Biophysics, 28(3), 315-422.