Mesothelin:癌症免疫治疗的后起之秀
日期:2019-09-24 14:14:17
间皮素(Mesothelin)又被称为MSLN,它是由MSLN基因编码的一种细胞表面糖蛋白。MSLN基因编码一种前蛋白,经蛋白水解后产生巨核细胞增强因子(megakaryocyte-potentiating factor,MPF)和间皮素两种蛋白产物。巨核细胞增强因子是一种能够刺激骨髓巨核细胞集落形成的细胞因子。间皮素是通过糖基磷脂酰肌醇锚定在细胞表面的蛋白。
间皮素是一种存在于正常间皮细胞上的分化抗原。在正常组织中很少表达,但是在间皮瘤、肺癌、胰腺癌、乳腺癌、卵巢癌等肿瘤中均有高表达[1],因此间皮素有可能成为癌症治疗的重要靶点。
1. 间皮素的发现
该蛋白首先由其与单克隆抗体K1[2]的反应活性被鉴定。间皮素能被单克隆抗体K1特异性识别。Chang等人从能与单克隆抗体K1发生反应的海拉(hela)细胞系的基因文库中提取互补DNA克隆出间皮素基因。之所以将其命名为间皮素,因该基因编码产生的膜结合蛋白主要位于正常间皮细胞表面。
2. 间皮素结构特征
间皮素基因位于染色体16 p13.3,其基因全长8 kb,cDNA大小为213 bp,含有1884 bp的开放阅读框,17个外显子,编码628个氨基酸。MSLN基因编码一个71 KD的前体蛋白。该前体蛋白被弗林(furin)蛋白酶水解为两个部分:一个可溶性31 kD N端蛋白称为巨核细胞增强因子(megakaryocyte-potentiating factor,MPF)和一个40 kD膜结合片段称为MSLN [3]。
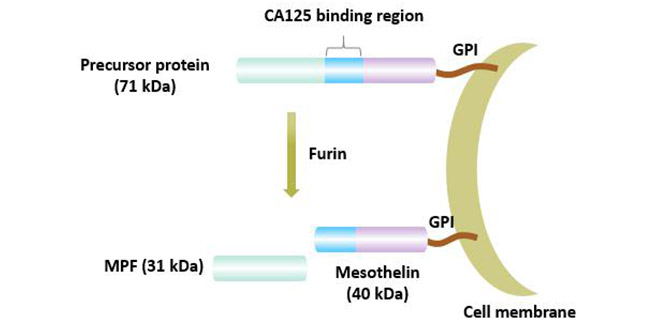
图1间皮素的成熟过程
目前认为间皮素至少存在3个异构体,其中膜结合的间皮素是最常见的间皮素的变体;间皮素V-1具有额外的8个氨基酸,并且它也是与膜结合的形式;间皮素V-2具有修饰的COOH末端,是间皮素在蛋白酶的作用下水解,然后从细胞表面脱落而成,称为可溶性间皮素相关肽(soluble mesothelin-related peptide,SMRP)[4]。
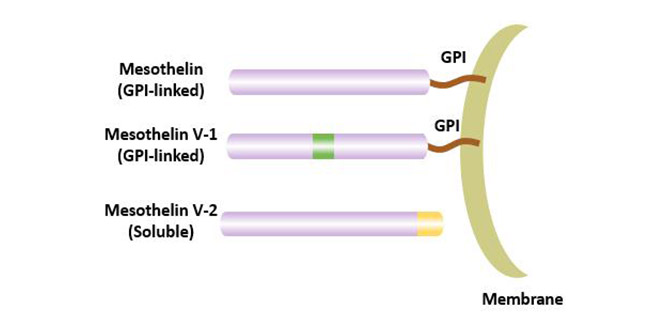
图2 间皮素的异构体
2.1 可溶性间皮素
间皮素的可溶形式是在氨基酸的600位删除COOH-末端与膜结合的氨基酸发生移码突变和转录过早终止而造成异常接合,影响间皮素与细胞膜的联接。可溶性间皮素蛋白大小一般为42-45 kDa,其NH2-末端的氨基酸序列与膜结合间皮素相同。可溶性的间皮素的来源可能是膜结合间皮素的蛋白水解产物,也可能是通过可变剪接得到的。可溶性间皮素可以在一些间皮素阳性肿瘤患者的血中检测到,测定血中的间皮素可用于某些疾病的诊断。
3. 间皮素的表达
间皮素可表达于正常胸膜、心包和腹膜的间皮细胞中,它在气管,卵巢,睾丸,扁桃体和输卵管的上皮细胞表面上表达最低。此外,作为与肿瘤侵袭有关的细胞表面抗原,它还在多种肿瘤组织中高表达,主要包括间皮瘤、卵巢和胰腺腺癌等。
3.1 间皮素在恶性肿瘤中的表达
MSLN被发现在多种癌症中过度表达。目前在间皮瘤、卵巢癌、肺癌,食道癌,胰腺癌[5],胃癌,胆管癌,子宫内膜癌,胸腺癌,结肠癌和乳腺癌中均观察到间皮素的过表达。
随肿瘤亚型的不同,MSLN表达的频率和分布而不同。
MSLN被发现表达在90%的上皮样恶性胸膜间皮瘤,69%的肺腺癌,60%的乳腺癌和46%的食管癌中[6]。
在癌细胞内,MSLN的表达可能是在腔/膜或细胞质。不同类型的肿瘤MSLN的表达位置也有一定的差异。在间皮瘤肿瘤中,MSLN表达在细胞表面,呈均匀分布。在肺腺癌中,MSLN在细胞质和细胞表面均有表达。在胃癌中,细胞质表达比膜表达更为普遍。
MSLN还在甲状腺、肾脏和滑膜肉瘤肿瘤等实体肿瘤中表达。
4. 间皮素的生物学功能
研究人员曾对MSLN基因敲除的小鼠进行研究,发现这些基因敲除小鼠表现出正常的发育、繁殖和血细胞计数[7]。这说明间皮素并非小鼠正常生长发育繁殖所必需。也正因为如此,到目前为止,间皮素的生物学功能目前仍不清楚。
有研究表明间皮素可能在粘附中发挥作用。随着人们对肿瘤中间皮素的研究越来越深入,已经发现它在多种肿瘤的发生发展中起着重要作用。MSLN的过表达可激活NF-κB,MAPK和PI3K通路,并通过诱导MMP7和MMP9的激活和表达诱导细胞凋亡或促进细胞增殖,迁移和转移。
MSLN异常表达在肿瘤细胞增殖、黏附及耐药性方面起着重要作用。
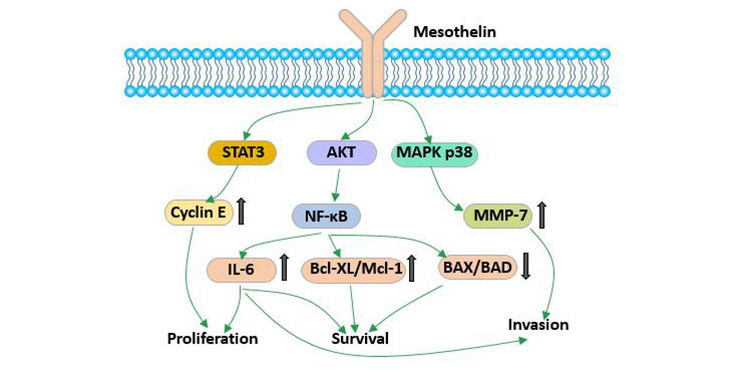
图3 间皮素的生物学功能
4.1 细胞增殖和细胞周期
在胰腺癌的研究中发现,间皮素可以促进肿瘤细胞增殖。沉默胰腺癌肿瘤细胞中的间皮素基因可以抑制增殖。间皮素可以通过减缓细胞进入S期而抑制细胞周期[8]。间皮素的超量表达则会持续激活NF-κB信号通路并产生高水平的IL-6,从而激活转录蛋白Stat3,导致与细胞周期相关的cyclin E和周期蛋白依赖激酶2(cyclin-dependent kinase 2,CDK2)的表达量增高。这最终加速了细胞从G1期到S期的转变。
4.2 细胞黏附和转移
研究表明,转染了间皮素的小鼠胚胎成纤维细胞3T3与未转染的细胞相比,前者与培养皿附着更牢固、更难从细胞表面清除,这表明间皮素可能与细胞黏附有关。Rump等[9]在卵巢癌的研究中发现,MSLN与CA125的高亲和力相互作用导致细胞间的异型黏附,促进卵巢癌细胞系的转移。MSLN的表达以及血清SMRP水平的升高与肿瘤的进展、分期的增加以及总体生存率的降低有关。
5. 间皮素的应用
5.1 肿瘤治疗的疫苗
间皮素是一种具有强烈免疫原性的蛋白质,因此可用于制作抗肿瘤疫苗。 CRS-207是Aduro公司开发的一款以李斯特菌为载体的肿瘤疫苗,其作用机制是巨噬细胞将入侵细菌吞噬内化加工处理,将间皮素抗原呈递给T细胞,释放淋巴因子,激活杀伤性T细胞靶向间皮素,最终引起表达间皮素的肿瘤细胞凋亡。
5.2 肿瘤诊断标志物
可溶性间皮素可在实体肿瘤患者血清中检测到,这使其成为表达间皮素的肿瘤有价值的诊断工具。酶联免疫吸附试验(ELISA)可用于检测血浆可溶性间皮素。可溶性间皮素自身缺乏敏感性及特异性,但与CA125联合检测可提高诊断效率[13]。间皮素结合其他卵巢肿瘤标志物可应用于卵巢癌的筛查。
5.3 肿瘤特异性免疫治疗的靶点
鉴于间皮素在多种人类恶性肿瘤细胞中高度表达,在正常组织中很少表达,因而间皮素有望用于肿瘤特异性治疗的靶点。目前针对MSLN设计了各种免疫治疗策略,主要包括基于抗体疗法和CAR-T的药物的设计。
迄今报道的MSLN靶向免疫治疗具有良好的安全性[14] [15]。MSLN是许多常见实体肿瘤中潜在的CAR靶点。
5.3.1 抗体类药物
抗体类药物主要通过抗体中和、抗体依赖细胞介导的细胞毒性(ADCC)、抗体依赖细胞介导的吞噬作用(ADCP)、抗体与效应分子(毒素或抑制剂)结合等方式来介导细胞凋亡或抑制细胞增殖,靶向杀伤肿瘤细胞。
matuximab(MORAb-009)是一种嵌合抗体,由抗间皮素抗体SS1单链可变区片段与人IgG1/κ恒定区组成,通过抗体依赖的细胞介导的细胞毒作用(ADCC)杀伤肿瘤细胞,并可阻断间皮素与CA125的相互作用[16]。
Anetumab Ravtansine (BAY94-9343)是一种抗体偶联药物,由抗间皮素抗体与美登素衍生物DM4(微管蛋白聚合酶抑制剂)组成[17]。BAY94-9343通过抗间皮素抗体与肿瘤细胞表面间皮素结合后,可被内化进入溶酶体然后释放DM4杀伤肿瘤细胞。
DMOT4039A是由人源化IgG1抗间皮素单克隆抗体h7D9 v3(α-MSLN)与抗微管蛋白药物monomethyl auristatin E(MMAE)通过二肽连接而成的抗体偶联药物。DMOT4039A主要通过网格蛋白介导的内吞作用进入溶酶体并释放出MMAE,随后与细胞质的微管蛋白结合从而阻滞细胞周期的G2/M期,使细胞生长停滞、诱导凋亡。
MDX-1204是由全人源间皮素抗体(MDX-1383)与一种烷化剂duocarmycin(MED2460)偶联而成的抗体偶联药物[18]。MDX-1204与间皮素的结合阻断其与CA125之间的相互作用。MDX-1204与间皮素结合后被细胞内化并释放出小分子药物MED2460,MED2460通过与DNA小沟结合,引起DNA不可逆烷基化,进而破坏核酸结构,最终导致细胞死亡。
- Amatuximab
- Anetumab Ravtansine
- DMOT4039A
- MDX-1204
5.3.2 免疫毒素
SS1P是重组免疫毒素,它是由小鼠抗间皮素抗体的可变区片段与假单胞菌外毒素38(PE38)融合而成[19]。SS1(dsFv)PE38是一种重组的抗间皮素免疫毒素,目前正在对间皮素表达肿瘤患者进行临床评估。许多基于MSLN抗体SS1或其他改良和人性化版本的药物已被开发用于靶向治疗。
5.3.3 嵌合抗原受体T细胞疗法
嵌合抗原受体T细胞(CAR)通常由细胞外抗原识别域(通常由抗体的单链可变片段(single chain variable fragment, scFv)衍生而来)、作为细胞质膜锚定的跨膜域和传递T细胞活化信号的细胞内域组成。
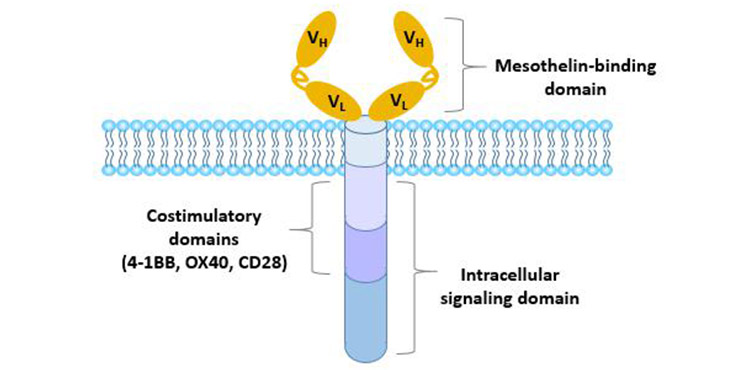
图4 嵌合抗原受体的结构
第一代CAR只包含一个细胞内信号域,通常是CD3ζ链,这足以启动T细胞活化,但只产生短期增殖活性和低水平的细胞毒性。
第二代CAR通过加入另一种共刺激分子(CD28、4-1BB或OX40)大大提高了效能。
第三代CAR含有两个共刺激结构域(CD28,4-1BB,TLR2或DAP10)和铰链结构域,在细胞增殖、细胞毒性、持久性和肿瘤抑制效果方面更优。
第四代CAR,可以分泌细胞因子或其他效应分子,如IL-12,IL-15,IL-7或CCL19,以调节免疫微环境。
关于CAR-T的详细信息,这篇文章有更为详细的介绍:细胞免疫治疗-CAR-T细胞疗法。
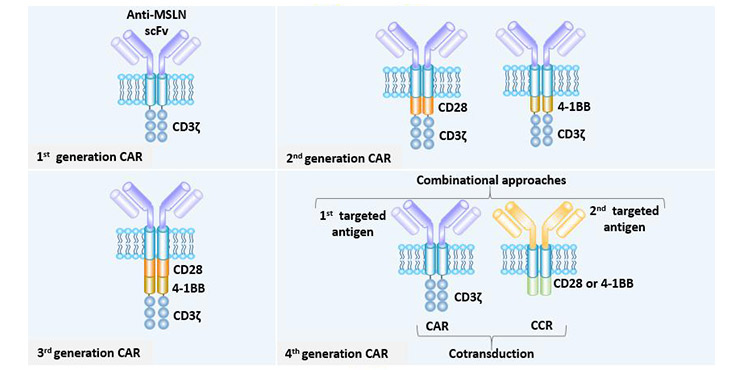
图5 MSLN CAR的改进
间皮素CAR-T细胞治疗在间皮瘤、卵巢癌、肺癌小鼠移植模型中取得了令人鼓舞的结果,相应的一些临床试验也已获批,目前正在进行中[20] [21]。
提高CAR-T细胞的效率,是CAR-T疗法中的主要问题之一。这主要需要从以下几个方面着手:
促进CAR-T细胞浸润;
增强CAR-T细胞的功能持久性;
增强CAR-T细胞以克服肿瘤微环境中遇到的抑制信号;
通过预防靶向/非肿瘤毒性来提高安全性。
将MSLN CAR-T细胞设计成过度表达趋化因子受体CCR2B被证明可增强T细胞向实体肿瘤的转运。因为间皮瘤细胞高度表达其趋化因子配体CCL2,而T细胞仅表达少量CCR2B。CCR2B过表达显著提高了系统给药的治疗效率。
为鼎力协助科研和药企人员针对Mesothelin(MSLN)的在肿瘤中的临床应用研究,CUSABIO推出MSLN活性蛋白(Code:CSB-MP015044HUc9),助力您在MSLN机制方面的研究或其潜在临床价值的探索。
华美 CUSABIO MSLN 蛋白
Recombinant Human Mesothelin (MSLN), partial (Active) Code: CSB-MP015044HUc9
by SDS-PAGE
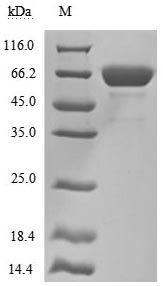
The high purity is greater than 95% as determined by SDS-PAGE.
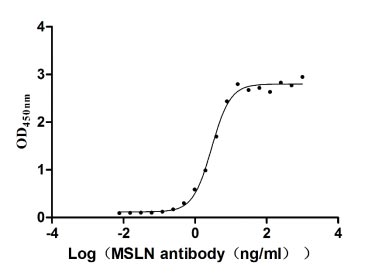
Immobilized MSLN at 2 μg/ml can bind Anti-MSLN rabbit monoclonal antibody. The EC50 of the MSLN protein is 2.657-3.177 ng/ml.
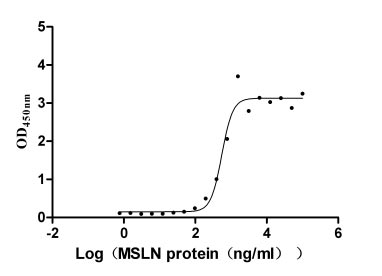
Immobilized MUC16 (CSB-MP704410HU3c7) at 10 μg/ml can bind MSLN. The EC50 is 460.7-662.2 ng/ml.
参考文献:
[1] Paolo B, Sara C. Amatuximab and novel agents targeting mesothelin for solid tumors [J]. OncoTargets and Therapy, 2017, Volume 10: 5337-5353.
[2] Chang K. Characterization of the antigen (CAK1) recognized by monoclonal antibody K1 present on ovarian cancers and normal mesothelium [J]. Cancer Res, 1992, 52(1): 181-186.
[3] Manzanares M, Campbell D J W, Maldonado G T, et al. Overexpression of periostin and distinct mesothelin forms predict malignant progression in a rat cholangiocarcinoma model [J]. Hepatol Commun, 2018, 2(2): 155-172.
[4] Burt B M, Lee H S, Rosen V L D, et al. Soluble Mesothelin-Related Peptides to Monitor Recurrence After Resection of Pleural Mesothelioma [J]. Annals of Thoracic Surgery, 2017, 104(5): 1679.
[5] Argani P. Mesothelin is overexpressed in the vast majority of ductal adenocarcinomas of the pancreas: Identification of a new pancreatic cancer marker by serial analysis of gene expression (SAGE) [J]. Clin Cancer Res, 2001, 7.
[6] Morello A, Sadelain M, Adusumilli P S. Mesothelin-Targeted CARs: Driving T cells to Solid Tumors [J]. Cancer Discovery, 2015, 6(2).
[7] Bera T K, Pastan I. Mesothelin Is Not Required for Normal Mouse Development or Reproduction [J]. Molecular and Cellular Biology, 2000, 20(8): 2902-2906.
[8] Guadalupe A M, Beate P, Calderón-Aranda Emma S, et al. Biomarkers for Predicting Malignant Pleural Mesothelioma in a Mexican Population [J]. International Journal of Medical Sciences, 2018, 15(9): 883-891.
[9] Rump A, Morikawa Y, Tanaka M, et al. Binding of Ovarian Cancer Antigen CA125/MUC16 to Mesothelin Mediates Cell Adhesion [J]. Journal of Biological Chemistry, 2004, 279(10): 9190-9198.
[10] Bharadwaj U, Marin-Muller C, Li M, et al. Mesothelin confers pancreatic cancer cell resistance to TNF-α-induced apoptosis through Akt/PI3K/NF-κB activation and IL-6/Mcl-1 overexpression [J]. Molecular Cancer, 2011, 10(1): 106.
[11] Cheng W F, Huang C Y, Chang M C, et al. High mesothelin correlates with chemoresistance and poor survival in epithelial ovarian carcinoma [J]. BRITISH JOURNAL OF CANCER, 2009, 100(7): 1144-1153.
[12] Moon R T, Prieve M G. Stromelysin-1 and mesothelin are differentially regulated by Wnt-5a and Wnt-1 in C57mg mouse mammary epithelial cells [J]. BMC Developmental Biology, 2003, 3(1): 1-10.
[13] Bast R C. Status of tumor markers in ovarian cancer screening [J]. Journal of clinical oncology: official journal of the American Society of Clinical Oncology, 2003, 21(10 Suppl): 200s.
[14] Villena-Vargas J, Adusumilli P S. Mesothelin-targeted immunotherapies for malignant pleural mesothelioma [J]. Annals of Cardiothoracic Surgery, 2012, 1(4): 466.
[15] Pastan I, Hassan R. Discovery of Mesothelin and Exploiting It as a Target for Immunotherapy [J]. Cancer Research, 2014, 74(11): 2907-2912.
[16] Hassan R, Ebel W, Routhier E L, et al. Preclinical evaluation of MORAb-009, a chimeric antibody targeting tumor-associated mesothelin [J]. Cancer Immunity, 2007, 7: 20.
[17] Grosso F, Scagliotti G V. Systemic treatment of malignant pleural mesothelioma [J]. Future Oncology, 2012, 8(3): 293-305.
[18] Pogue S, Chen X, Alexander S, et al. Fully human antimesothelin antibody drug conjugate demonstrates antitumor effects in human lung cancer models [J]. Clinical Cancer Research, 2008, 14(15 Supplement): A13-A13.
[19] Kolyvas E, Rudloff M, Poruchynsky M, et al. Mesothelin-targeted immunotoxin RG7787 has synergistic anti-tumor activity when combined with taxanes [J]. Oncotarget, 2017, 8(6): 9189.
[20] Beatty GL, Haas AR, Maus MV, et al. Mesothelin-Specific Chimeric Antigen Receptor mRNA-Engineered T Cells Induce Antitumor Activity in Solid Malignancies [J]. Cancer Immunology Research, 2015, 3(2): 217.
[21] Adusumilli P S, Cherkassky L, Villena-Vargas J, et al. Regional delivery of mesothelin-targeted CAR T cell therapy generates potent and long-lasting CD4-dependent tumor immunity [J]. Science Translational Medicine, 2014, 6(261): 261ra151-261ra151.
上一篇: 解读|美国癌症研究协会(AACR)2019年度癌症进展报告出炉
下一篇: 线粒体内膜蛋白OMA1











